Hạt nhân nguyên và số hiệu nguyên tử là gì? Vật lý 12
Nguyên tử là những hạt rất nhỏ tồn tại hầu hết trong các dạng vật chất. Hạt nhân nguyên tử chiếm khối lượng chủ yếu trong cấu tạo nguyên tử. Đây được xem là đề tài nghiên cứu vô cùng quan trọng đến sự phát triển của nhiều lĩnh vực hiện nay. Trong bài viết sau, Marathon Education sẽ cùng với các em tìm hiểu chi tiết hơn về khái niệm và cấu tạo của hạt nhân nguyên tử.
>>> Xem thêm: Lý Thuyết Và Cách Học Thuộc Nhanh Bảng Tuần Hoàn Hóa Học Lớp 10
Hạt nhân nguyên tử là gì?
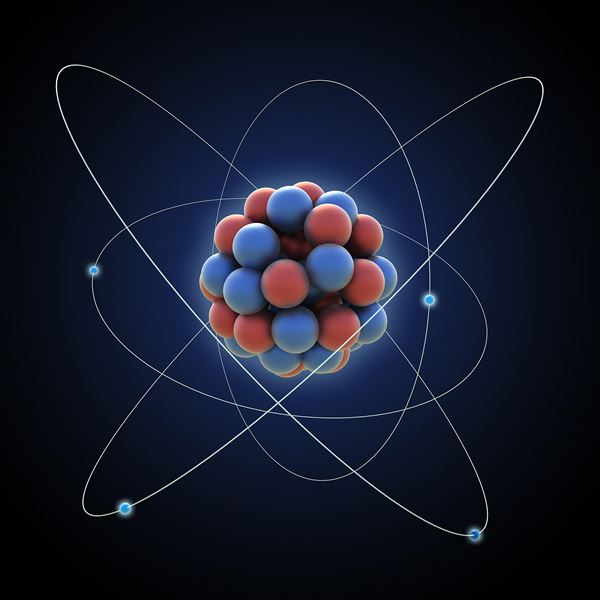
Hạt nhân nguyên tử là cấu trúc vật chất đậm đặc (mật độ có thể đạt đến 100 triệu tấn/cm3), chiếm gần như là toàn bộ khối lượng của nguyên tử. Theo một số hiểu biết hiện nay thì kích thước của hạt nhân nguyên tử nằm trong vùng giới hạn có bán kính khoảng 10– 15m.
Hạt nhân nguyên tử có cấu tạo từ những hạt nào?
Hạt nhân nguyên tử được cấu tạo từ 2 loại hạt proton và nơtron
- Hạt Proton: Proton có nghĩa là “thứ nhất” trong tiếng Hy Lạp. Đây là hạt mang điện tích +1 và có khối lượng xấp xỉ bằng 1.67262158 × 10-27 kg (938.278 MeV/c2).
- Hạt Nơtron: Loại hạt này không mang điện tích và có khối lượng gần bằng 1.67492716 × 10-27 kg (939.571 MeV/c2), lớn hơn khối lượng của proton.
>>> Xem thêm: Lý Thuyết Hóa 10: Thành Phần Nguyên Tử, Kích Thước Và Khối Lượng
Các lý thuyết liên quan đến hạt nhân nguyên tử
Nguyên tố hóa học

Định nghĩa
Nguyên tố hóa học được hiểu là các nguyên tử có cùng điện tích hạt nhân với nhau (cùng Z). Đến ngày nay, người ta đã biết đến 94 nguyên tố hóa học có trong tự nhiên và 24 nguyên tố nhân tạo được tạo ra từ các phòng thí nghiệm hạt nhân (tổng cộng 118 nguyên tố).
Ví dụ: Tất cả các nguyên tử có cùng số đơn vị điện tích hạt nhân là 8 đều thuộc nguyên tố Oxi, chúng đều có 8 proton và 8 electron.
Số hiệu nguyên tử
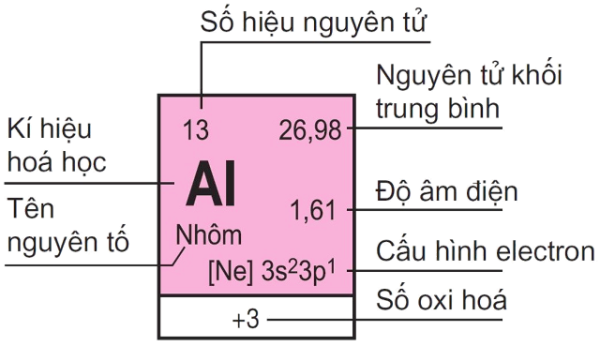
Số hiệu nguyên tử chính là số đơn vị điện tích hạt nhân của nguyên tố đó. Kí hiệu là Z.
Ký hiệu nguyên tử
Những đặc trưng cơ bản của nguyên tử là số khối và số đơn vị điện tích hạt nhân. Do vậy, để kí hiệu nguyên tử người ta thường đặt các chỉ số đặc trưng ở bên trái kí hiệu nguyên tố X (số khối A ở phía trên và số hiệu nguyên tử Z ở phía dưới) là:
^A_ZX
Ví dụ:
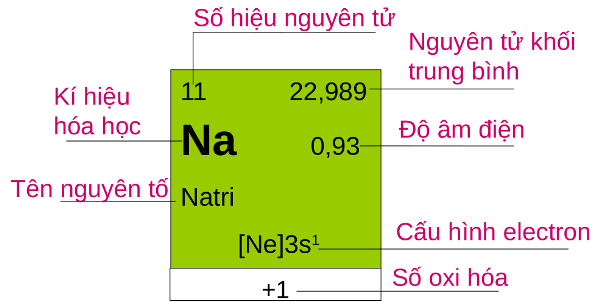
Từ ví dụ trên, ta biết được số khối của nguyên tử Natri là 23 và số hiệu nguyên tử là 11. Vì vậy, số đơn vị điện tích hạt nhân của Na là 11 (có 11 proton và 11 electron) và trong hạt nhân có 12 notron.
>>> Xem thêm: Lý Thuyết Và Cách Viết Cấu Hình Electron Nguyên Tử
Đồng vị
Các nguyên tử có cùng một nguyên tố hóa học có thể có số khối khác nhau (vì hạt nhân của nguyên tử đó có số proton giống nhau) nhưng có thể có số nơtron khác nhau.
Các đồng vị của cùng một nguyên tố hoá học thường là những nguyên tử giống nhau số proton và khác số nơtron. Chúng được xếp vào cùng 1 ô nguyên tố trong bảng hệ thống tuần hoàn hóa học.
Do vậy, số khối của các đồng vị cũng sẽ khác nhau.
* Lưu ý: Ngoài tự nhiên có khoảng 340 đồng vị, và người ta còn tổng hợp thêm 2400 đồng vị nhân tạo dùng trong y học, nông nghiệp.
Ví dụ: Nguyên tố Hidro (H2) có 3 đồng vị như sau:
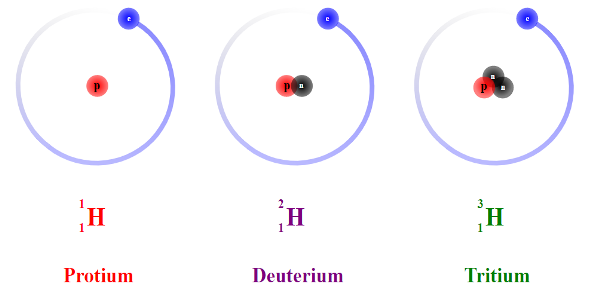
Nguyên tử khối
Nguyên tử khối chính là khối lượng tương đối của một nguyên tử và cho biết khối lượng của nguyên tử đó nặng bao nhiêu lần đơn vị khối lượng nguyên tử.
Khối lượng của một nguyên tử bằng tổng khối lượng của proton + nơtron + electron trong nguyên tử đó. Nhưng bởi vì khối lượng của electron quá nhỏ bé so với hạt nhân nên thường khối lượng một nguyên tử coi như bằng hạt nhân nguyên tử đó.
Vì vậy, nguyên tử khối được xem như bằng số khối (A).
Ví dụ: Xác định nguyên tử khối của P biết rằng P có N = 16 và Z = 15
Vậy nguyên tử khối của P là 31.
>>> Xem thêm: Cấu Tạo Vỏ Nguyên Tử – Lý Thuyết Hóa 10 Và Bài Tập Vận Dụng
Nguyên tử khối trung bình
Trong tự nhiên, nhiều nguyên tố hóa học tồn tại nhiều đồng vị nên nguyên tử khối của các nguyên tố này là nguyên tử khối trung bình của các đồng vị đó.
Giả sử một nguyên tố bất kì có 2 đồng vị X và Y, X là nguyên tử khối của đồng vị X và Y là nguyên tử khối của đồng vị Y, a là phần trăm số nguyên tử của X và b là phần trăm số nguyên tử của Y. Do đó, ta được công thức tính nguyên tử khối trung bình của A là:
\overline{A}=\frac{aX+bY}{100}
Tham khảo ngay các khoá học online của Marathon Education
Qua bài viết này, Team Marathon Education đã cung cấp cho các em một số khái niệm và cấu tạo của hạt nhân nguyên tử. Điều này không chỉ giúp các em vận dụng vào làm bài tập hiệu quả hơn mà còn hỗ trợ giải đáp một số hiện tượng trong đời sống. Do vậy, các em hãy thường xuyên theo dõi website của Marathon để học trực tuyến nhiều thông tin hữu ích khác nhé. Chúc các em học tập tốt và đạt thành tích vượt trội!
Các Bài Viết Liên Quan