Lý thuyết Cân bằng Hóa học 10 | Marathon Education
Khi học môn Hóa, các em sẽ được nghe nhiều đến khái niệm cân bằng hóa học. Đây cũng là nội dung quan trọng mà các em cần nắm vững để giải quyết các bài toán trong chương trình Hóa học lớp 10 nói riêng, Hóa THCS và THPT nói chung. Vậy, cân bằng hóa học là gì? Trong bài viết này, Marathon Education sẽ cung cấp cho các em đầy đủ những kiến thức về lý thuyết này.
Phản ứng một chiều và phản ứng thuận nghịch
Khi học về cân bằng hóa học, các em sẽ được biết đến 2 loại phản ứng. Đó chính là phản ứng một chiều và phản ứng thuận nghịch.
Đúng như tên gọi, phản ứng một chiều là phản ứng chỉ xảy ra theo đúng một chiều từ trái sang phải. Điều này có nghĩa là sau phản ứng, chất phản ứng sẽ biến đổi thành chất sản phẩm và không xảy ra phản ứng theo chiều ngược lại. Khi viết phương trình hóa học, các em cần sử dụng mũi tên để chỉ chiều phản ứng.
2KClO_3 \xrightarrow{t^\circ} 2KCl+3O_2
Ngược lại, phản ứng xảy ra theo 2 chiều trái ngược nhau trong cùng một điều kiện được gọi là phản ứng thuận nghịch. Cụ thể, chất phản ứng biến đổi thành chất sản phẩm và ngược lại, chất sản phẩm cũng sẽ phản ứng với nhau tạo thành chất tham gia phản ứng. Vì thế, khi viết phương trình hoá học, các em nên sử dụng hai mũi tên ngược chiều nhau.
Cl_2+H_2O ⇌ HCl+HClO
Cân bằng hóa học là gì?
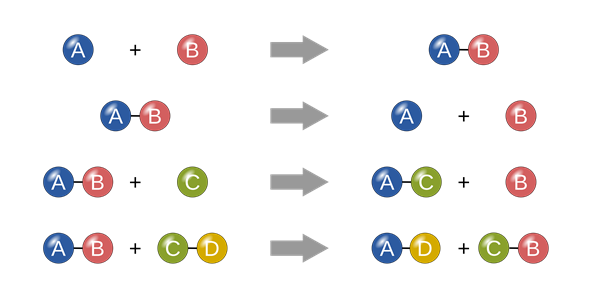
Cân bằng hóa học là một trạng thái của phản ứng thuận nghịch khi tốc độ phản ứng thuận và phản ứng nghịch bằng nhau.
Như vậy, cân bằng hóa học được xác định là cân bằng động. Ở trạng thái cân bằng luôn có sự xuất hiện của chất phản ứng và chất sản phẩm.
>>> Xem thêm:
- Bài Tập Cân Bằng Phương Trình Hóa Học Và 5 Cách Cân Bằng Đơn Giản
- 8 Cách Cân Bằng Phương Trình Hóa Học Nhanh Và Chính Xác
Hằng số cân bằng hóa học
Cân bằng trong hệ đồng thể
Hệ đồng thể là hệ gồm các chất có tính chất vật lý và tính chất hóa học như nhau ở tất cả các vị trí trong hệ. Ví dụ, hệ gồm các chất tan trong dung dịch, hệ gồm các chất khí.
Chẳng hạn, một phản ứng thuận nghịch được xảy ra như sau:
aA + bB ⇌ cC + dD
Trong đó, A, B, C, D là những chất tan trong dung dịch hoặc chất khí có phản ứng ở trạng thái cân bằng. Ta có:
K = \frac{[C]^c.[D]^d}{[A]^a.[B]^b}
[A], [B], [C], [D] là theo thứ tự là nồng độ mol/l của các chất A, B, C, D và a, b, c, d là hệ số của các chất trong phương trình phản ứng.
Hằng số cân bằng K của phản ứng xác định chỉ phụ thuộc vào nhiệt độ mà không phụ thuộc vào nồng độ chất phản ứng.
Nếu cân bằng hóa học được thiết lập giữa các chất khí thì các em có thể thay nồng độ các chất trong biểu thức tính K bằng áp suất riêng phần của hỗn hợp.
Cân bằng trong hệ dị thể
Khác với hệ đồng thể, hệ dị thể là hệ gồm các chất có tính chất vật lý và hóa học không giống nhau ở mọi vị trí ở trong hệ. Ví dụ, hệ bao gồm các chất tan trong nước và chất rắn, hệ bao gồm chất khí và chất rắn.
Các em hãy xét hệ cân bằng hóa học sau:
C_{(r) }+ CO_{2\ (k) } ⇌ 2CO_{ (k)}\\
K = \frac{[CO]^2}{[CO_2]}
Nồng độ các chất rắn được coi là hằng số.
Sự chuyển dịch cân bằng hóa học
Sự dịch chuyển cân bằng hóa học là sự phá vỡ trạng thái cân bằng cũ và chuyển sang trạng thái cân bằng mới. Nguyên nhân chính là do các yếu tố bên ngoài tác động đến cân bằng.
Các yếu tố ảnh hưởng đến cân bằng hóa học
Yếu tố nồng độ
Các em hãy xét cân bằng hóa học sau:
C_{(r)} + CO_{2\ (k)} ⇌ 2CO_{(k)}
Khi CO2 tăng thì cân bằng sẽ chuyển dịch theo chiều thuận (làm giảm CO2). Ngược lại, khi giảm CO2 thì cân bằng này sẽ chuyển dịch theo chiều nghịch, tức là chiều làm tăng CO2.
Vì thế, khi tăng hay giảm nồng độ một chất trong cân bằng hóa học thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động của chất đó theo hướng tăng hoặc giảm nồng độ. Các em cũng nên lưu ý, chất rắn là chất không làm ảnh hưởng đến cân bằng của hệ.
Yếu tố áp suất
Các em hãy xét cân bằng hóa học sau:
N_2O_{4\ (k)} ⇌ 2NO_{2\ (k)}
Khi áp suất tăng thì cân bằng sẽ chuyển dịch theo chiều làm giảm áp suất. Khi áp suất giảm thì cân bằng sẽ chuyển dịch theo chiều làm tăng áp suất.
Như vậy, khi tăng hay giảm áp suất chung của hệ cân bằng thì cân bằng hóa học sẽ chuyển dịch theo chiều làm giảm tác động của việc tăng hoặc giảm áp suất đó.
Các em cần lưu ý rằng, nếu số mol khí ở 2 vế bằng nhau (hoặc không có chất khí tham gia phản ứng) thì áp suất không ảnh hưởng đến cân bằng.
H_{2\ (k)} + I_{2 (k)} ⇌ 2HI_{ (k)}
Yếu tố nhiệt độ
Yếu tố nhiệt độ liên quan đến phản ứng thu nhiệt và phản ứng tỏa nhiệt. Cụ thể, phản ứng thu nhiệt là phản ứng lấy thêm năng lượng để tạo ra sản phẩm, được kí hiệu là ΔH>0. Phản ứng tỏa nhiệt là phản ứng giảm bớt năng lượng, được kí hiệu là ΔH<0.
\begin{array}{ccc}
ΔH= −58kJ&N_2O_{4\ (k) }⇌ NO_{2\ (k)}&ΔH = +58kJ
\end{array}
Xét phản ứng trên các em sẽ thấy:
Phản ứng thuận thu nhiệt vì ΔH = +58kJ > 0
Phản ứng nghịch tỏa nhiệt vì ΔH= −58kJ < 0
Tóm lại, nhiệt độ có ảnh hưởng đến cân bằng hóa học. Khi nhiệt độ tăng, cân bằng sẽ chuyển dịch theo chiều phản ứng thu nhiệt (để giảm tác động tăng nhiệt độ). Khi nhiệt độ giảm, cân bằng sẽ chuyển dịch theo chiều phản ứng tỏa nhiệt (để giảm tác động giảm nhiệt độ).
Theo nguyên lí chuyển dịch cân bằng Lơ Sa-tơ-li-ê thì một phản ứng thuận nghịch đang ở trạng thái cân bằng nếu chịu một tác động từ bên ngoài như sự biến đổi nồng độ, áp suất hay nhiệt độ thì cân bằng hóa học sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.
Yếu tố chất xúc tác
Chất xúc tác không ảnh hưởng đến cân bằng hóa học. Sự xuất hiện của chất xúc tác làm tăng tốc độ phản ứng thuận và phản ứng nghịch với số lần bằng nhau. Khi phản ứng chưa cân bằng thì chất xúc tác sẽ làm cho cân bằng được thiết lập nhanh hơn.
Ý nghĩa của tốc độ phản ứng và cân bằng hóa học trong sản xuất hóa học
Trong sản xuất hóa học, các nhà hóa học có thể dựa vào các yếu tố làm ảnh hưởng đến phản ứng và cân bằng hóa học để chọn ra những chất sản xuất họa hóc hiệu quả, tăng tốc độ phản ứng hóa học hay quyết định chất tạo thành dựa trên phản ứng thuận nghịch của phương trình hóa học.
Cụ thể, ta xét ví dụ sản xuất Axit Sunfuric:
2SO2 (k) + O2 (k) ⇌ 2SO3 ∆H = -198kJ < 0.
Trong phản ứng trên, phản ứng sẽ chuyển dịch theo chiều nghịch nếu tăng nhiệt độ (giảm hiệu suất phản ứng). Do đó, để tăng hiệu suất phản ứng (phản ứng chuyển dịch theo chiều thuận), các nhà hóa học tăng nồng độ Oxi cho phản ứng.
>>> Xem thêm: Tổng Hợp Các Công Thức Hóa Học Từ Lớp 8 Đến Lớp 12 Cần Nhớ
Bài tập cân bằng hóa học
Bài tập 1: Cho hệ cân bằng sau được thực hiện trong bình kín:
2SO2 (k) + O2 (k) ⇌ 2SO3 ∆H < 0
Yếu tố nào dưới đây không làm nồng độ các chất trong hệ cân bằng biến đổi?
a. Nhiệt độ
b. Áp suất
c. Chất xúc tác
d. Dung tích của bình
Lời giải: c là đáp án chính xác. Trong phản ứng thuận nghịch, chất xúc tác làm tăng tốc độ phản ứng cả 2 chiều với tỷ lệ bằng nhau. Vì vậy, nồng độ các chất trong hệ cân bằng không bị biến đổi do chất xúc tác.
Bài tập 2: Cho Clo phản ứng với H2O theo phương trình phản ứng sau:
Cl2 + H2O ⇌ HClO + HCl
HClO bị phân hủy dưới tác dụng của ánh sáng theo phương trình phản ứng:
2HClO ⇌ 2HCl + O2
Vì sao nước Clo không bảo quản được lâu?
Lời giải: Dưới tác dụng của ánh sáng, HClO không bền nên bị phân hủy hoàn toàn tạo thành HCl và O2. Khi đó phản ứng chuyển dịch theo chiều thuận do nồng độ HClO giảm. Sau đó, HCl và O2 lại tiếp tục tác dụng với nhau tạo thành HClO. Theo thời gian, HClO bị phân hủy dần dần cho đến hết. Do đó, nước Clo không bảo quản được lâu.
Bài tập 3: Cho phương trình phản ứng:
4CuO (r) ⇌ 2Cu2O (r) + O2 (k) ∆H > 0
Để tăng hiệu suất chuyển hóa CuO thành Cu2O có những phương pháp nào?
Lời giải: Ta có thể thực hiện 2 phương pháp sau
- Tăng nhiệt độ phản ứng để phản ứng chuyển dịch theo chiều thuận (do ∆H > 0)
- Giảm áp suất phản ứng bằng cách rút bớt khí Oxi
Tham khảo ngay các khoá học online của Marathon Education
Từ những thông tin mà các Marathon Education đã chia sẻ ở trên, chắc hẳn các em đã có đủ tự tin để trả lời câu hỏi cân bằng hóa học là gì cũng như nắm vững các yếu tố liên quan đến chuyển dịch cân bằng hóa học. Các em hãy cố gắng học thuộc, ghi nhớ toàn bộ lý thuyết liên quan đến cân bằng hóa học vì đây là kiến thức quan trọng sẽ hỗ trợ các em rất nhiều trong quá trình giải bài tập.
Hãy liên hệ ngay với Marathon để được tư vấn nếu các em có nhu cầu học trực tuyến nâng cao kiến thức nhé! Marathon Education chúc các em được điểm cao trong các bài kiểm tra và kỳ thi sắp tới!
Các Bài Viết Liên Quan






