Phản Ứng Hóa Học Là Gì? Các Loại Phản Ứng Hóa Học Lớp 8
Hóa học là bộ môn mà các em được học khi bước vào lớp 8 và sẽ đồng hành trong suốt những năm học còn lại của cấp 2 và cấp. Hóa học nói về các nguyên tố hóa học, hợp chất,… và sự phản ứng của các chất với nhau. Vậy, phản ứng hóa học là gì? Lớp 8, có các loại phản ứng hóa học thường gặp nào? Các em hãy cùng Marathon Education tìm hiểu qua bài viết sau.
Phản ứng hóa học là gì?

Phản ứng hóa học là sự biến đổi từ chất này sang chất khác. Cụ thế, từ một chất ban đầu nếu các em kết hợp với chất khác thì các chất này có thể sẽ xảy ra phản ứng và bị biến đổi.
Trong bất kỳ một phản ứng hóa học nào, luôn có sự xuất hiện của 2 thành phần là chất tham gia và chất sản phẩm. Chất tham gia chính là chất ban đầu, chất bị biến đổi khi tham gia phản ứng. Chất sinh ra sau đó là chất sản phẩm.
Cách biểu diễn phản ứng hóa học như sau:
Tên các chất tham gia phản ứng → Tên chất sản phẩm
Các em lưu ý, tên chất tham gia và chất sản phẩm cần được viết ở dạng công thức hóa học và có hệ số tương ứng với mỗi chất.
Nếu các chất tham gia xảy ra phản ứng hoàn toàn thì các chất tham gia sẽ chuyển hết thành chất sản phẩm và không xảy ra phản ứng ngược lại. Lúc này, các em sử dụng mũi tên một chiều để viết phản ứng.
Tuy nhiên, nếu các chất tham gia không chuyển hết thành sản phẩm thì đây là phản ứng thuận nghịch. Khi viết phản ứng, các em sử dụng mũi tên 2 chiều.
>>> Xem thêm: Bảng Tuần Hoàn Hóa Các Nguyên Tố Hóa Học Lớp 8, 9, 10 Cách Đọc Và Mẹo Nhớ Nhanh
Diễn biến của phản ứng hóa học
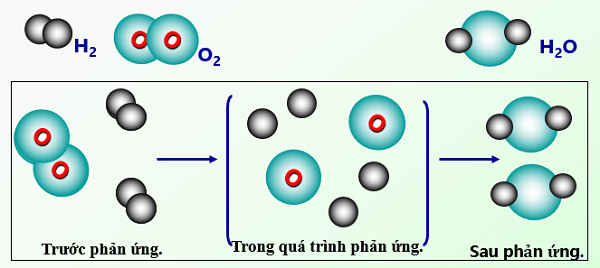
Để biết được diễn biến của phản ứng hóa học các em hãy theo dõi một ví dụ cụ thể đó là sự tạo thành phân tử nước từ 2 thành phần là Oxi và Hidro.
Trước khi xảy ra phản ứng, 2 nguyên tử Oxi liên kết với nhau và 2 nguyên tử Hidro liên kết với nhau. Sau phản ứng, 1 nguyên tử Oxi sẽ liên kết với 2 nguyên tử Hidro. Như vậy, trong quá trình phản ứng, liên kết giữa 2 nguyên tử Oxi và 2 nguyên tử Hidro bị đứt gãy.
2H_2 + O_2 \xrightarrow{t^\circ} 2H_2O
Tóm lại, trong một phản ứng hóa học bất kỳ, chỉ có liên kết giữa các nguyên tử thay đổi làm cho phân tử này biến đổi thành phân tử khác.
>>> Xem thêm: Bảng Hóa Trị Lớp 8 Về Các Nguyên Tố Hóa Học Thường Gặp Và Bài Ca Hóa Trị
Điều kiện để phản ứng hóa học xảy ra
Một số phản ứng hóa học có thể xảy ra tức thời chỉ cần các chất tiếp xúc với nhau mà không cần phải cung cấp năng lượng ban đầu cho chúng.
Tuy nhiên, nhiều phản ứng chỉ xảy ra khi được đun nóng đến nhiệt độ thích hợp.
Ngoài ra, một vài phản ứng hóa học khác cần chất xúc tác để phản ứng xảy ra nhanh hơn. Sau phản ứng, chất xúc tác sẽ không bị biến đổi.
Tổng hợp các loại phản ứng hóa học

Phản ứng hóa hợp
Phản ứng hóa hợp là phản ứng hóa học của hai hay nhiều chất và chỉ tạo thành một chất sản phẩm. Ví dụ:
\begin{aligned}
&4P + 5O_2 \xrightarrow{t^\circ} 2P_2O_5\\
&3Fe + 2O2 \xrightarrow{t^\circ} Fe3O4\\
&Na_2O + H_2O → 2NaOH\\
&CaO + H_2O → Ca(OH)_2\\
&SO_3 + H_2O → H_2SO_4\\
&2Fe + 3Cl_2 \xrightarrow{t^\circ} 2FeCl_3\\
&N_2O_5 + 3H_2O → 2HNO_3
\end{aligned}
Phản ứng phân hủy
Phản ứng phân hủy là phản ứng hóa học của một chất ban đầu bị phân hủy thành hai hay nhiều chất khác nhau. Ví dụ:
\begin{aligned}
&2KMnO_4 \xrightarrow{t^\circ} K_2MnO_4 + MnO_2 + O_2\\
&2KClO_3 \xrightarrow{500^\circ\ C} 2KCl + 3O_2\\
&CaCO_3 \xrightarrow{900^\circ\ C} CaO + CO_2\\
&2Fe(OH)_3 \xrightarrow{t^\circ} Fe_2O_3 + H_2O
\end{aligned}
Phản ứng oxi hóa – khử
Phản ứng oxi hóa khử là phản ứng hóa học mà các chất tham gia có xảy ra sự oxi hóa và sự khử. Nói cách khác, phản ứng oxi hóa khử là phản ứng có sự dịch chuyển electron giữa các chất trong phản ứng hay phản ứng có sự thay đổi số oxi hóa của một số nguyên tố. Chất khử là chất nhường electron và chất oxi hóa là chất nhận electron.
Ví dụ:
\overset{0}{Zn} + 2\overset{+2}{Fe}SO_4 → \overset{+2}{Zn}SO_4 + \overset{0}{Fe}
>>> Xem thêm: Cách Viết Phương Trình Hóa Học Oxi Hóa – Khử Từ A Đến Z
Phản ứng thế
Phản ứng thế là phản ứng giữa các đơn chất và hợp chất. Trong đó, nguyên tử của đơn chất sẽ thay thế nguyên tử của một nguyên tố khác trong hợp chất. Ví dụ:
\begin{aligned}
&Zn + 2HCl → ZnCl_2 + H_2\\
&Fe + CuCl_2 → FeCl_2 + Cu\\
&Fe + H_2SO_4 → FeSO_4 + H_2\\
&Mg + H_2SO_4 → MgSO_4 + H_2\\
&2Al + 6HCl → 2AlCl_3 + 3H_2
\end{aligned}
>>> Xem thêm: Dãy Hoạt Động Hóa Học Của Kim Loại Là Gì? Ý Nghĩa Và Mẹo Nhớ Nhanh
Phản ứng tỏa nhiệt
Phản ứng tỏa nhiệt là phản ứng hóa học có đi kèm hiện tượng giải phóng năng lượng ở dạng nhiệt. Chẳng hạn như phản ứng đốt cháy xăng dầu tạo năng lượng để máy móc, phương tiện giao thông vận hành…
Tham khảo ngay các khoá học online của Marathon Education
Team Marathon vừa tổng hợp và chia sẻ cho các em những kiến thức về phản ứng hóa học. Những thông tin cơ bản này chính là nền tảng để giúp các em học tốt môn Hóa hơn đấy. Vì thế, các em hãy ghi chú lại để làm tư liệu cần thiết cho việc học, giải bài tập Hóa học sau này. Các em cũng đừng quên theo dõi Marathon để học trực tuyến thêm nhiều kiến thức bổ ích. Chúc các em có một ngày học tập hiệu quả!
Các Bài Viết Liên Quan