Bazơ Là Gì? Lý Thuyết Về Tính Chất Hóa Học Của Bazơ
Bazơ là một hợp chất thường gặp trong chương trình hóa trung học cơ sở và trung học phổ thông. Việc hiểu rõ những kiến thức như bazơ là gì, công thức hóa học của bazơ cũng như tính chất hóa học của bazơ sẽ giúp các em xử lý tốt các dạng bài tập liên quan và học tốt môn học này. Các em hãy cùng Team Marathon Education tìm hiểu những nội dung này trong bài viết sau nhé.
Bazơ là gì?
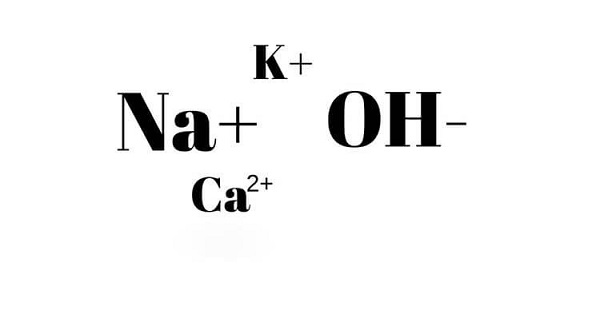
Trước khi tìm hiểu về tính chất hóa học của bazơ, các em cần phải hiểu rõ khái niệm bazơ là gì. Bazơ, hay còn được gọi là hiđroxit kim loại, là một loại hợp chất có cấu tạo gồm 1 nguyên tử kim loại liên kết với 1 hay nhiều nhóm hidroxit (-OH).
Công thức hóa học của bazơ có dạng chung là A(OH)x, trong đó A là nguyên tử kim loại, x là số hoá trị của nguyên tử kim loại.
Ví dụ: NaOH, Cu(OH)2, Fe(OH)3,…
Cách đọc tên bazơ
Các em hãy đọc tên bazơ theo nguyên tắc chung sau đây:
Tên bazơ = Tên kim loại + (Hóa trị nếu kim loại có nhiều hóa trị) + Hidroxit
Ví dụ:
Al(OH)3 : nhôm hidroxit
Fe(OH)2: sắt (II) hidroxit
Fe(OH)3: sắt (III) hidroxit
Phân loại bazơ
Bazo được phân loại dựa trên tính tan của hợp chất như sau:
- Bazơ tan được trong nước (còn gọi là bazơ kiềm và kiềm thổ): LiOH, NaOH, KOH, Ba(OH)2, Ca(OH)2,…
- Bazơ không tan trong nước: Al(OH)3, Cu(OH)2, Fe(OH)3,…
- Mg(OH)2 tan được trong nước nóng.
Ngoài ra, bazơ còn được phân loại dựa vào một số đặc điểm khác như:
- Bazơ kim loại: Al(OH)3, Cu(OH)2, Fe(OH)3,…
- Các nhóm amin có tính kiềm và amoniac (NH3)
- Các hợp chất hữu cơ chứa vòng thơm có tính bazơ hoặc các hợp chất bazơ vòng thơm khác: C6H6 (benzen) và các đồng đẳng của benzen…
Tính chất hóa học của bazơ

Tác dụng với chất chỉ thị màu
Dung dịch bazơ làm quỳ tím đổi thành màu xanh.
Dung dịch bazơ làm phenolphthalein từ không màu đổi sang màu hồng.
Tác dụng với axit tạo thành muối và nước
Một tính chất hóa học của bazơ khác là khả năng tác dụng với axit sinh ra muối và nước. Phản ứng hóa học này của bazơ còn có tên gọi khác là phản ứng trung hòa.
Ví dụ:
KOH + HCl → KCl + H2O
Cu(OH)2 + 2HNO3 → Cu(NO3)2 + H2O
>>> Xem thêm: Axit Là Gì? Lý Thuyết Về Tính Chất Hóa Học Của Axit
Tác dụng với oxit axit tạo thành muối và nước
Bazơ tác dụng với oxit axit sinh ra muối và nước.
Ví dụ:
2NaOH + SO2 → Na2SO3 + H2O
3Ca(OH)2 + P2O5 → Ca3(PO4)2↓ + 3H2O
Tác dụng với muối tạo thành muối mới và bazơ mới
Bazơ tan tác dụng với muối sinh ra muối mới và bazơ mới.
Ví dụ:
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
>>> Xem thêm: Muối Là Gì? Lý Thuyết Về Tính Chất Hóa Học Của Muối
Tính chất hóa học của bazơ không tan là bị nhiệt phân hủy tạo thành oxit và nước
Bazơ không tan bị nhiệt phân hủy tạo thành oxit và nước.
Ví dụ:
\footnotesize Cu(OH)_2 \xrightarrow{t^\circ} CuO+H_2O\\
\footnotesize Fe(OH)_3 \xrightarrow{t^\circ} Fe_2O_3+H_2O
Các ứng dụng của bazơ trong cuộc sống

Bazơ có khá nhiều ứng dụng trong các ngành nghề khác nhau như ngành y dược, ngành thực phẩm, ngành dầu khí, ngành công nghiệp dệt, ngành công nghiệp hoá chất:
- Xử lý nước hồ bơi: Bazơ có khả năng tăng độ pH cho nước khi hoà tan.
- Xử lý nước trong ống dẫn nước: Bazơ giúp trung hoà và khử sạch cặn bẩn có trong đường ống dẫn nước.
- Ứng dụng trong ngành công nghiệp hoá chất, ngành dược: Bazơ có thể được sử dụng để điều chế ra sản phẩm làm trắng răng, chất khử trùng,…
- Bazơ dùng để sản xuất nước rửa chén nhờ tính năng thuỷ phân chất béo trong dầu mỡ động vật.
- Bazơ dùng để sản xuất hóa chất xử lý mối mọt cho gỗ, tre nứa…
- Ứng dụng trong công nghiệp dệt may: Bazơ được dùng làm chất phân huỷ pectins, sáp để xử lý vải thô giúp vải có độ bóng, sáng và dễ nhuộm màu.
- Ứng dụng trong khai thác dầu: Bazơ được dùng làm chất cân bằng độ pH cho dàn khoan dầu khí.
- Bazơ được dùng pha chế dung dịch kiềm để rửa rau, hoa quả trước khi chế biến, đóng gói.
- Bazơ còn được dùng làm chất hỗ trợ nghiên cứu, làm các thí nghiệm trong phòng thí nghiệm hóa học của viện nghiên cứu, công ty hoặc nhà trường.
Bài tập về tính chất hóa học của bazơ
Bài tập 1: Nêu cách nhận biết các dung dịch sau: H2SO4, NaOH, HCl
Lời giải:
Bước 1: Dùng quỳ tím để nhận biết axit và bazơ
- Các dung dịch axit H2SO4 và HCl làm quỳ chuyển màu đỏ
- Dung dịch bazơ NaOH làm quỳ tím hóa xanh
Bước 2: Dùng BaCl2 nhận biết 2 dung dịch axit còn lại
- Dung dịch không có phản ứng là HCl.
- Dung dịch có kết tủa trắng xuất hiện là H2SO4.
BaCl + H2SO4 → BaSO4 + HCl
Bài tập 2: Nêu cách nhận biết 3 loại phân bón KCl, NH4NO3, Ca(H2PO4)2 bằng dung dịch Ca(OH)2.
Lời giải:
Bước 1: Lấy 3 mẫu thử từ 3 loại phân bón
Bước 2: Lần lượt cho 3 mẫu thử vào 3 ống nghiệm chứa dung dịch Ca(OH)2 sau đó đun nhẹ
- Ống nghiệm không có hiện tượng gì xảy ra là phân bón KCl.
- Ống nghiệm có xuất hiện kết tủa màu trắng là phân bón Ca(H2PO4)2.
Ca(OH)2 + Ca(H2PO4)2 → Ca3(PO4)3 + 4H2O
- Ống nghiệm có xuất hiện khí có mùi khai là phân bón NH4NO3.
Ca(OH)2 + 2NH4NO3 → Ca(NO3)2 + 2NH3 +H2O
Bài tập 3: Cho 3 bazơ sau Mg(OH)2, KOH, Ba(OH)2. Hãy cho biết những bazơ nào thỏa mãn các điều kiện dưới đây và viết phương trình phản ứng (nếu có).
a. Tác dụng được với với dung dịch HCl.
b. Bị nhiệt phân hủy
c. Tác dụng được CO2
d. Đổi màu quỳ tím thành xanh
Lời giải:
a. Cả 3 bazơ đều tác dụng với dung dịch HCl.
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
KOH + HCl → KaCl + H2O
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
b. Chỉ có bazơ Mg(OH)2 bị nhiệt phân hủy vì đây là bazơ không tan.
\small Mg(OH)_2 \xrightarrow{t^o} MgO + H_2O
c. Chỉ có 2 bazơ KOH và Ba(OH)2 tác dụng với CO2.
KOH + CO2 → K2CO3 + H2O
Ba(OH)2 + CO2 → BaCO3 + H2O
d. Chỉ có 2 bazơ KOH và Ba(OH)2 làm đổi màu quỳ tím thành xanh.
Bài tập 4: Hoàn thành các phương trình hóa học dưới đây:
a. … → Fe2O3 +3H2O
b. H2SO4 + … → MgSO4 + 2H2O
c. NaOH + … → NaCl + H2O
d. … + CO2 → Na2CO3 + H2O
e. CuSO4 + … → Cu(OH)2 + 2H2O
Lời giải:
a. Fe(OH)3→Fe2O3 +3H2O
b. H2SO4 + Mg(OH)2 → MgSO4 + 2H2O
c. NaOH + HCl → NaCl + H2O
d. 2NaOH + CO2 → Na2CO3 + H2O
e. CuSO4 + 2KOH → Cu(OH)2 + 2H2O
Bài tập 5: Cho 15,5 g Na2O tác dụng với nước, thu được 0,5 lít dung dịch bazơ.
a. Viết phương trình phản ứng và tính nồng độ mol của dung dịch bazơ thu được
b. Tính thể tích dung dịch H2SO4 20%, có khối lượng riêng 1,4 g/ml cần dùng để trung hòa dung dịch bazơ thu được.
Lời giải
\begin{aligned}
& a.
\\
& \text{Phương trình phản ứng: } Na_2O + H_2O → 2NaOH
\\
& \text{Số mol dung dịch NaOH: } n_{NaOH} = 2n_{Na_2O} = 2.\frac{m}{M} = 2.\frac{15,5}{62} = 0,5 \ mol
\\
\
\\
& \text{Nồng độ mol dung dịch NaOH: } C_{M(NaOH)} = \frac{n}{V} = \frac{0,5}{0,5} = 1 \ M
\\
& b.
\\
& \text{Phương trình phản ứng: } 2NaOH + H_2SO_4 → Na_2SO_4 + 2H_2O
\\
& \text{Số mol } H_2SO_4 \text{: } n_{H_2SO_4} = \frac{1}{2}n_{NaOH} = \frac{1}{2}.0,5 = 0,25 \ mol
\\
& \text{Khối lượng } H_2SO_4 \text{: } m_{H_2SO_4} = n.M = 0,25.98 = 24,5 \ g
\\
& \text{Khối lượng dung dịch } H_2SO_4 \text{: } m_{dd(H_2SO_4)} = \frac{m_{H_2SO_4}}{C \%} = \frac{24,5}{20 \%} = 122,5 \ g
\\
\
\\
& \text{Thể tích dung dịch } H_2SO_4 \text{: } V_{H_2SO_4} = \frac{m_{dd}}{d} = \frac{122,5}{1,14} = 107,5 \ ml
\end{aligned}
Tham khảo ngay các khoá học online của Marathon Education
Trên đây là bài viết về những kiến thức về bazơ bao gồm công thức hóa học của bazơ và tính chất hóa học của bazơ đã được các Team Marathon Education biên soạn. Hy vọng phần nội dung về kiến thức này sẽ giúp ích cho các em trong quá trình học tập. Các em cũng có thể học online trực tuyến các kiến thức hữu ích khác về môn hoá, môn lý, môn toán tại website Marathon. Chúc các em học tập tốt!
Các Bài Viết Liên Quan